คำถามที่ 1. คำใดที่เรียกว่าตัวเร่งปฏิกิริยา?
สารที่เปลี่ยนความเร็วของปฏิกิริยาเคมีโดยไม่เปลี่ยนแปลงจนกระทั่งสิ้นสุดเรียกว่าตัวเร่งปฏิกิริยา
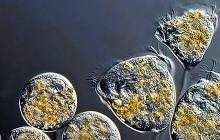
โภชนาการ 2. เอนไซม์มีบทบาทอย่างไรในเซลล์?
เอนไซม์เป็นตัวเร่งปฏิกิริยาทางชีวภาพที่ช่วยเร่งปฏิกิริยาเคมีในเซลล์ที่มีชีวิต โมเลกุลของเอนไซม์บางชนิดประกอบด้วยโปรตีนทั้งหมด ในขณะที่โมเลกุลอื่นๆ รวมถึงโปรตีนและสารประกอบที่ไม่ใช่โปรตีน (อินทรีย์ - โคเอ็นไซม์ หรืออนินทรีย์ - ไอออนของโลหะชนิดต่างๆ) เอนไซม์มีความเฉพาะเจาะจงมาก: เอนไซม์ของผิวหนังกระตุ้นปฏิกิริยาประเภทเฉพาะที่เกี่ยวข้องกับการมีส่วนร่วมของโมเลกุลที่จำเพาะของสารตั้งต้น
อุปทาน 3. ปัจจัยประเภทใดที่อาจส่งผลต่อความลื่นไหลของปฏิกิริยาของเอนไซม์?
การไหลของปฏิกิริยาของเอนไซม์ขึ้นอยู่กับความเข้มข้นของเอนไซม์ ลักษณะของสาร อุณหภูมิ ความดัน และปฏิกิริยาของตัวกลาง (เปรี้ยวหรือเปรี้ยว) เป็นส่วนใหญ่
ในเอนไซม์จำนวนมากที่มีจิตใจดี เช่น ต่อหน้าโมเลกุลบางชนิด การกำหนดค่าของแอคทีฟเซ็นเตอร์จะเปลี่ยนไป ซึ่งช่วยให้พวกมันมั่นใจได้ว่ามีกิจกรรมของเอนไซม์ที่ยิ่งใหญ่ที่สุด
โภชนาการ 4. ทำไมจึงมีเอ็นไซม์เข้ามามากขึ้น อุณหภูมิสูงใช้พลังงานตัวเร่งปฏิกิริยา?
อุณหภูมิแกนกลางที่สูงนำไปสู่การเสื่อมสภาพของโปรตีน เช่น การทำลายโครงสร้างตามธรรมชาติ ดังนั้นที่อุณหภูมิสูง เอนไซม์ส่วนใหญ่จะสูญเสียพลังในการเร่งปฏิกิริยา
โภชนาการ 5. เหตุใดการขาดวิตามินจึงทำให้กระบวนการสำคัญของร่างกายหยุดชะงัก?
วิตามินจำนวนมากเข้าไปในคลังของเอนไซม์ ดังนั้นการขาดวิตามินในร่างกายทำให้กิจกรรมของเอนไซม์ในเซลล์ลดลงและยังสามารถทำให้เกิดการหยุดชะงักในกระบวนการสำคัญได้อีกด้วย
1.8. ตัวเร่งปฏิกิริยาทางชีวภาพ
4.3 (86.15%) 52 คะแนนในหน้านี้พวกเขาล้อเล่น:
- เอนไซม์มีบทบาทอย่างไรในเซลล์?
- คำใดที่เรียกว่าตัวเร่งปฏิกิริยา
- เหตุใดจึงมีเอนไซม์มากขึ้นที่อุณหภูมิสูง?
- ความเร็วของปฏิกิริยาเอนไซม์อาจขึ้นอยู่กับปัจจัยบางประการ
- เหตุใดเอนไซม์จึงเสียมากขึ้นที่อุณหภูมิสูง?
สภาพคล่องของปฏิกิริยาเคมี- เปลี่ยนจำนวนคำโต้ตอบหนึ่งคำต่อชั่วโมงในพื้นที่โต้ตอบเดียว
 ปัจจัยต่อไปนี้มีอิทธิพลต่อความเร็วของปฏิกิริยาเคมี:
ปัจจัยต่อไปนี้มีอิทธิพลต่อความเร็วของปฏิกิริยาเคมี:
- ธรรมชาติของคำพูดเชิงโต้ตอบ
- ความเข้มข้นของสารที่ทำปฏิกิริยา
- พื้นผิวของพื้นผิวของสารที่ทำปฏิกิริยา (ในปฏิกิริยาที่ต่างกัน)
- อุณหภูมิ;
- กิจกรรมของตัวเร่งปฏิกิริยา
ทฤษฎีการปิดระบบที่ใช้งานอยู่ซึ่งช่วยให้ฉันสามารถอธิบายอิทธิพลของปัจจัยต่างๆ ที่มีต่อความลื่นไหลของปฏิกิริยาเคมีได้ บทบัญญัติหลักของทฤษฎีนี้:
- ปฏิกิริยาเกิดขึ้นเมื่ออนุภาคของรีเอเจนต์เชื่อมต่อกันซึ่งประกอบด้วยพลังงานที่มีพลัง
- ยิ่งมีอนุภาคของรีเอเจนต์มากเท่าไร กลิ่นก็จะยิ่งอยู่ใกล้กันมากขึ้นเท่านั้น ก็ยิ่งมีโอกาสที่พวกมันจะมีปฏิกิริยาและตอบสนองมากขึ้นเท่านั้น
- ก่อนเกิดปฏิกิริยา จำเป็นต้องสร้างมาตรการรับมือที่มีประสิทธิภาพมากขึ้นก่อน นี่คือวิธีที่ "ความสัมพันธ์เก่า" ต่อสู้และอ่อนแอลง และด้วยเหตุนี้จึงสามารถสร้าง "ความสัมพันธ์ใหม่" ได้ ส่วนความผิดของแม่ส่วนไหนที่มีพลังงานเพียงพอ
- เรียกว่าพลังงานส่วนเกินขั้นต่ำที่จำเป็นสำหรับการทำงานร่วมกันอย่างมีประสิทธิภาพของอนุภาครีเอเจนต์ พลังงานกระตุ้น Ea
- กิจกรรมของสารประกอบเคมีนั้นแสดงออกมาในพลังงานกระตุ้นต่ำของปฏิกิริยาเมื่อมีส่วนร่วม ยิ่งพลังงานกระตุ้นต่ำเท่าไร ความลื่นไหลของปฏิกิริยาก็จะยิ่งมากขึ้นเท่านั้นตัวอย่างเช่น ในปฏิกิริยาระหว่างแคตไอออนและแอนไอออน พลังงานกระตุ้นต่ำมาก ดังนั้นปฏิกิริยาดังกล่าวจึงดำเนินไปในลักษณะบรรเทาน้อยลง
การไหลเข้าของความเข้มข้นของสารที่ทำปฏิกิริยาเข้าสู่ของเหลวของปฏิกิริยา
เมื่อความเข้มข้นของสารที่ทำปฏิกิริยาเพิ่มขึ้น ความลื่นไหลของปฏิกิริยาจะเพิ่มขึ้น เพื่อให้เกิดปฏิกิริยาได้ ชิ้นส่วนทางเคมีทั้งสองจะต้องอยู่ใกล้กัน ดังนั้นความเร็วของปฏิกิริยาจึงขึ้นอยู่กับปริมาณการสัมผัสระหว่างกัน การเพิ่มจำนวนอนุภาคในกระบวนการนี้จะส่งผลให้มีการหยุดทำงานมากขึ้นและความลื่นไหลของปฏิกิริยาเพิ่มขึ้น
หากต้องการเพิ่มความเร็วของปฏิกิริยาที่เกิดขึ้นในเฟสแก๊ส ให้ขยับรอง หรือเปลี่ยนแรงดันที่ใช้
จากข้อมูลการทดลองตั้งแต่ปี 1867 ศตวรรษของนอร์เวย์โดย K. Guldberg และ P. Waage และเป็นอิสระจากพวกเขาในปี 1865 คำสอนของรัสเซีย N.I. เบเคตอฟได้กำหนดกฎพื้นฐานของจลนศาสตร์เคมีซึ่งกำหนดไว้ ระดับความลื่นไหลของปฏิกิริยาขึ้นอยู่กับความเข้มข้นของสารที่ทำปฏิกิริยา
กฎของมวลแอคทีฟ (LDM):
 สภาพคล่องของปฏิกิริยาเคมีเป็นสัดส่วนกับความเข้มข้นของสารประกอบที่ทำปฏิกิริยาซึ่งนำมาจากระดับของสัมประสิทธิ์ปฏิกิริยาที่เท่ากัน (“diyucha masa” เป็นคำพ้องสำหรับแนวคิดรายวัน “ความเข้มข้น”)
สภาพคล่องของปฏิกิริยาเคมีเป็นสัดส่วนกับความเข้มข้นของสารประกอบที่ทำปฏิกิริยาซึ่งนำมาจากระดับของสัมประสิทธิ์ปฏิกิริยาที่เท่ากัน (“diyucha masa” เป็นคำพ้องสำหรับแนวคิดรายวัน “ความเข้มข้น”)
เอเอ+บีบี =ซีซี +ดีดีเดอ เค- ความเร็วปฏิกิริยาคงที่
ZDM ไม่มีปฏิกิริยาเคมีเบื้องต้นในขั้นตอนเดียว เนื่องจากปฏิกิริยาดำเนินไปตามลำดับผ่านหลายขั้นตอน ความเร็วโดยรวมของกระบวนการทั้งหมดจึงถูกระบุด้วยส่วนที่ยิ่งใหญ่ที่สุด

ไวรัสสำหรับของเหลวที่มีปฏิกิริยาประเภทต่างๆ
ZDM ขยายไปสู่ปฏิกิริยาที่เป็นเนื้อเดียวกัน หากปฏิกิริยาต่างกัน (สารรีเอเจนต์เกิดขึ้นในพืชมวลรวมต่างกัน) ปฏิกิริยาของ ZDM จะรวมเฉพาะรีเอเจนต์ที่หายากหรือคล้ายก๊าซ และของแข็งรวมอยู่ด้วย โดยไหลน้อยกว่าค่าคงที่สภาพคล่อง k
โมเลกุลของปฏิกิริยา– มีจำนวนโมเลกุลขั้นต่ำที่จำเป็นสำหรับกระบวนการทางเคมีเบื้องต้น ขึ้นอยู่กับความเป็นโมเลกุล ปฏิกิริยาเคมีเบื้องต้นแบ่งออกเป็นโมเลกุล (A →) และสองโมเลกุล (A + B →); ปฏิกิริยาไตรโมเลกุลเกิดขึ้นน้อยมาก
ความลื่นไหลของปฏิกิริยาที่ต่างกัน
- นอนลง พื้นผิวเรียบของซี่โครงที่ปิดสนิท, แล้ว.
- ขึ้นอยู่กับระดับของรายละเอียด ระดับของการผสมรีเอเจนต์
- ก้นเป็นภูเขาของหมู่บ้าน เป็นไปได้ที่จะเผาไหม้ในสายลมโดยสิ้นเชิง หากเพิ่มพื้นผิวไม้จากเนื้อไม้ โดยแยกไม้ออกเป็นชิ้นๆ ความลื่นไหลของไฟก็จะเพิ่มขึ้น
ไพโรฟอร์สามารถแขวนไว้บนแผ่นกระดาษกรองได้ ภายในหนึ่งชั่วโมง ส่วนที่พังของห้องโถงจะไหม้และทำให้กระดาษติดไฟ
การไหลเข้าของอุณหภูมิต่อความลื่นไหลของปฏิกิริยา
ในศตวรรษที่ 19 นักวิทยาศาสตร์ชาวดัตช์ Van't Hoff เปิดเผยอย่างแน่ชัดว่าเมื่ออุณหภูมิเพิ่มขึ้น 10°C ความลื่นไหลของปฏิกิริยาต่างๆ จะเพิ่มขึ้น 2-4 เท่า

กฎของแวนต์ ฮอฟฟ์
เมื่ออุณหภูมิบนผิวหนังเพิ่มขึ้น 10°C ความลื่นไหลของปฏิกิริยาจะเพิ่มขึ้น 2-4 เท่า
ในที่นี้ γ (ตัวอักษรกรีก "gama") เรียกว่าค่าสัมประสิทธิ์อุณหภูมิหรือค่าสัมประสิทธิ์ van't Hoff ซึ่งเพิ่มค่าจาก 2 เป็น 4
สำหรับปฏิกิริยาทางผิวหนังที่เฉพาะเจาะจง ค่าสัมประสิทธิ์อุณหภูมิจะถูกกำหนดเป็นขั้นตอนสุดท้าย โดยจะแสดงให้เห็นว่าความลื่นไหลของปฏิกิริยาเคมีเพิ่มขึ้นบ่อยเพียงใด (และค่าคงที่ความลื่นไหล) เมื่ออุณหภูมิผิวเพิ่มขึ้น 10 องศา

กฎของแวนต์ ฮอฟฟ์ใช้เพื่อประมาณการเปลี่ยนแปลงของค่าคงที่การไหลของปฏิกิริยาเนื่องจากอุณหภูมิเพิ่มขึ้นหรือลดลง นักเคมีชาวสวีเดน Svante Arrhenius ได้สร้างความสัมพันธ์ที่แม่นยำมากขึ้นระหว่างค่าคงที่สภาพคล่องและอุณหภูมิ: ชิมมากกว่า E ปฏิกิริยาเฉพาะดังนั้นน้อย
(ที่อุณหภูมินี้) จะมีค่าคงที่สภาพคล่อง k (และสภาพคล่อง) ของปฏิกิริยานี้ การเปลี่ยนแปลงใน T ส่งผลให้ค่าคงที่ของไหลเพิ่มขึ้น ซึ่งอธิบายได้จากข้อเท็จจริงที่ว่าการเปลี่ยนแปลงของอุณหภูมิส่งผลให้จำนวนโมเลกุลพลังงานเพิ่มขึ้นอย่างมาก ซึ่งมีส่วนช่วยในการกระตุ้นการทำงานของแบเรอร์ E a
การฉีดตัวเร่งปฏิกิริยาเพื่อความเร็วปฏิกิริยา
คุณสามารถเปลี่ยนความเร็วของปฏิกิริยา vikoryst และคำพิเศษที่เปลี่ยนกลไกของปฏิกิริยาและกำหนดทิศทางไปยังทิศทางที่มีพลังมากขึ้นโดยมีพลังงานกระตุ้นน้อยลง- คำเหล่านี้เป็นคำที่มีส่วนร่วมในปฏิกิริยาเคมีและเพิ่มสภาพคล่อง แต่หลังจากปฏิกิริยาเสร็จสิ้น คำเหล่านี้จะปราศจากผลกระทบที่ชัดเจนและเป็นกรดเหมือนเดิม
ยับยั้ง- คำพูดเพื่อเพิ่มปฏิกิริยาเคมี
เรียกว่าการเปลี่ยนความลื่นไหลของปฏิกิริยาเคมีหรือใช้ตัวเร่งปฏิกิริยาเพิ่มเติมโดยตรง การเร่งปฏิกิริยา .


แยก: เคมี
บทเรียนเมตา
- นาวาชาลนา:ยังคงกำหนดแนวคิดของ "ความเร็วของปฏิกิริยาเคมี" ต่อไปหาสูตรสำหรับการคำนวณความเร็วของปฏิกิริยาที่เป็นเนื้อเดียวกันและต่างกันพิจารณาว่าปัจจัยใดเป็นตัวกำหนดความเร็วของปฏิกิริยาเคมี
- การพัฒนา:อ่าน รวบรวมและวิเคราะห์ข้อมูลการทดลอง ตระหนักถึงปฏิสัมพันธ์ระหว่างความเร็วของปฏิกิริยาเคมีกับปัจจัยภายนอก
- วิคอฟนา:พัฒนาทักษะการสื่อสารอย่างต่อเนื่องระหว่างการทำงานเป็นคู่และเป็นกลุ่ม เน้นการเคารพนักเรียนถึงความสำคัญของความรู้เกี่ยวกับความลื่นไหลของปฏิกิริยาเคมีที่เกิดขึ้นในชีวิตประจำวัน (การกัดกร่อนของโลหะ การหมักนม การเน่าเปื่อย ฯลฯ)
ซาโซบี นาฟชันยา: D.เครื่องฉายมัลติมีเดีย, คอมพิวเตอร์, สไลด์จากบทเรียนหลัก, ซีดี“ Cyril และ Methodius”, ตารางบนโต๊ะ, โปรโตคอลในห้องปฏิบัติการ, อุปกรณ์ในห้องปฏิบัติการและรีเอเจนต์;
วิธีการเรียนรู้:การสืบพันธุ์, preslednitsky, chastkovo poshukova;
รูปแบบองค์กรรับ:การสนทนา งานภาคปฏิบัติ งานอิสระ การทดสอบ
รูปแบบการจัดงานของนักศึกษา:หน้าผาก, บุคคล, กลุ่ม, ส่วนรวม
1. การจัดชั้นเรียน
พร้อมที่จะทำงาน.
2. การเตรียมการสู่ขั้นตอนหลักของการเรียนรู้วัสดุพื้นฐาน การเปิดใช้งานความรู้พื้นฐานและสติปัญญา(สไลด์ 1 การนำเสนอที่น่าทึ่งก่อนบทเรียน)
หัวข้อบทเรียนคือความเร็วของปฏิกิริยาเคมี เจ้าหน้าที่ที่เติมสภาพคล่องของปฏิกิริยาเคมี”
คำเตือน: ทำความเข้าใจความลื่นไหลของปฏิกิริยาเคมี และประเภทของปฏิกิริยาที่ควรจัดเก็บ ในระหว่างบทเรียน เราจะเรียนรู้เกี่ยวกับทฤษฎีโภชนาการและสิ่งที่เราได้เรียนรู้ไปแล้ว สมมติฐานทางทฤษฎีของเราได้รับการยืนยันอย่างแท้จริง
คาดการณ์กิจกรรมของโรงเรียน
ผลงานที่กระตือรือร้นของนักเรียนแสดงให้เห็นถึงความพร้อมในการยอมรับบทเรียน ความรู้ที่จำเป็นสำหรับนักเรียนเกี่ยวกับความลื่นไหลของปฏิกิริยาเคมีในรายวิชาชั้นประถมศึกษาปีที่ 9 (การเชื่อมโยงรายวิชาภายใน)
ต่อรองได้ อาหารมา(ด้านหน้า สไลด์ 2):
- คุณต้องการความรู้อะไรบ้างเกี่ยวกับความเร็วของปฏิกิริยาเคมี
- ตัวอย่างใดบ้างที่สามารถใช้เพื่อยืนยันว่าปฏิกิริยาเคมีเกิดขึ้นในของเหลวชนิดต่างๆ
- คุณหมายถึงความลื่นไหลของ roc แบบกลไกอย่างไร? สภาพคล่องนี้มีหน่วยประเภทใด?
- คุณจะวัดความเร็วของปฏิกิริยาเคมีได้อย่างไร?
- คุณต้องทำอะไรเพื่อกระตุ้นปฏิกิริยาเคมี?
มาดูก้นสองอันกัน (ครูจะทำการทดลอง)
บนโต๊ะมีหลอดทดลองสองหลอด หลอดหนึ่งมีดอกไม้ (KOH) อีกหลอดมีดอกไม้ หากหลอดทดลองเกิดการขัดข้อง ให้เติม CuSO4 ลงไปเล็กน้อย เรากำลังมองหาอะไรอยู่?
คาดการณ์กิจกรรมของโรงเรียน
เรียนรู้ที่จะตัดสินความลื่นไหลของปฏิกิริยาและถอดส่วนประกอบต่างๆ ออกจากก้น การบันทึกปฏิกิริยาdoshtsі vikonnyh (นักเรียนสองคน)
ในกลุ่มตัวอย่างแรก ปฏิกิริยาคือ mittevo ส่วนอีกกลุ่มหนึ่งยังไม่มีการเปลี่ยนแปลงที่มองเห็นได้
ปฏิกิริยาที่คาดการณ์ได้ (นักเรียนสองคนลงทะเบียนสำหรับบทเรียน):
- CuSO 4 + 2KOH = Cu(OH) 2 + K 2 SO 4; ลูกบาศ์ก 2+ + 2OH - = ลูกบาศ์ก(OH) 2
- เฟ + CuSO 4 = FeSO 4 + Cu; เฟ 0 + Cu 2+ = เฟ 2+ + Cu 0
เราจะได้ความรู้ประเภทใดในการทำปฏิกิริยา? เหตุใดปฏิกิริยาหนึ่งจึงเกิดขึ้น mittevo และอีกปฏิกิริยาหนึ่งเกิดขึ้นอย่างสมบูรณ์? เพื่อจุดประสงค์นี้ จำเป็นต้องรู้ว่าปฏิกิริยาเคมีที่เกิดขึ้นในปริมาตรของพื้นที่ปฏิกิริยา (ในก๊าซหรือประเภทอื่น) คืออะไร และอื่นๆ ที่เกิดขึ้นเฉพาะเมื่อสิ้นสุดปฏิกิริยา (หัวเผา) แข็งในแก๊ส ซึ่งเป็นปฏิกิริยาระหว่างโลหะกับกรด โลหะที่มีฤทธิ์น้อย)
คาดการณ์กิจกรรมของโรงเรียน
ผลลัพธ์ของการทดลองที่สาธิตจะตามมาด้วยสิ่งต่อไปนี้:ปฏิกิริยาที่ 1 เป็นเนื้อเดียวกันและเป็นปฏิกิริยา
2-ต่างกัน
ความเร็วของปฏิกิริยาเหล่านี้สามารถคำนวณทางคณิตศาสตร์ได้หลายวิธี
ความรู้เกี่ยวกับความลื่นไหลและกลไกของปฏิกิริยาเคมีเรียกว่า จลนพลศาสตร์เคมี
3. การได้มาซึ่งความรู้ใหม่และวิธีการปฏิบัติ(สไลด์ 3)
ความลื่นไหลของปฏิกิริยาถูกกำหนดโดยการเปลี่ยนแปลงจำนวนคำต่อชั่วโมง
ในหน่วย V
(สำหรับเนื้อเดียวกัน)
บนพื้นผิวด้านหนึ่งมีเครือข่ายของเธรด S (สำหรับต่างกัน)
เห็นได้ชัดว่าด้วยค่าที่สำคัญของการไหลของปฏิกิริยานั้นไม่ได้อยู่ที่ปริมาตรของระบบที่เป็นเนื้อเดียวกันและจากพื้นผิวของรีเอเจนต์ - ไปจนถึงปริมาตรที่ต่างกัน
คาดการณ์กิจกรรมของโรงเรียน
กิจกรรมเชิงรุกของนักศึกษาจากสาขาวิชาการศึกษา เข้าโต๊ะก่อนจะเสร็จ
ใครจะชนะสอง. สำคัญในขณะนี้(สไลด์ 4):
2).
ตัวอย่างเช่นสำหรับปฏิกิริยา 2H 2 + O 2 = 2H 2 O: υ (โดย H 2) = 2 υ (โดย O 2) = υ (โดย H 2 O)
4. การรวมความรู้เบื้องต้นเกี่ยวกับความลื่นไหลของปฏิกิริยาเคมี
ในการรวมเนื้อหาที่ผ่านการตรวจสอบแล้ว จำเป็นต้องมีงานที่สำคัญมาก
คาดการณ์กิจกรรมของโรงเรียน
สิ่งแรกที่ต้องเข้าใจคือการปฏิเสธความรู้เกี่ยวกับความลื่นไหลของปฏิกิริยา ความถูกต้องของงาน
ซาฟดันเนีย (สไลด์ 5)ปฏิกิริยาเคมีเกิดขึ้นได้หลากหลาย คล้ายกับหินแกรนิต: A + B = C ความเข้มข้นเอาต์พุต: รูวินี A – 0.80 โมล/ลิตร, รูวินี – 1.00 โมล/ลิตร หลังจากผ่านไป 20 ชั่วโมง ความเข้มข้นของรูวิน A ลดลงเหลือ 0.74 โมล/ลิตร ค่าเฉลี่ย: ก) ความเร็วเฉลี่ยของปฏิกิริยาในช่วงเวลานี้
b) ความเข้มข้นของการพูดหลังจาก 20 นาที ความละเอียด (ภาคผนวก 4, สไลด์ 6)
5. การได้รับความรู้และวิธีการปฏิบัติใหม่ๆ(งานห้องปฏิบัติการดำเนินการในระหว่างการทำซ้ำและการแนะนำวัสดุใหม่ทีละขั้นตอนภาคผนวก 2)
เรารู้ว่าความลื่นไหลของปฏิกิริยาเคมีกำลังถูกเจ้าหน้าที่หลายฝ่ายดูดซับไว้ ยากิ?
คาดการณ์กิจกรรมของโรงเรียน
พึ่งความรู้เกรด 8-9 บันทึกตอนเรียนเนื้อหา ตอบสนองมากเกินไป (สไลด์ 7):
ธรรมชาติของคำพูดเชิงโต้ตอบ
อุณหภูมิ;
ความเข้มข้นของสารที่ทำปฏิกิริยา
กิจกรรมของตัวเร่งปฏิกิริยา
อยู่อันดับต้นๆ ของคำที่โต้ตอบ (ในปฏิกิริยาที่ต่างกัน)
การไหลเข้าของปัจจัยประกันภัยส่วนเกินทั้งหมดเข้าสู่ปฏิกิริยาสภาพคล่องสามารถอธิบายได้โดยใช้ทฤษฎีง่ายๆ: ทฤษฎีการปิดระบบ (สไลด์ 8)แนวคิดหลักคือ: ปฏิกิริยาเกิดขึ้นเมื่ออนุภาคของรีเอเจนต์รวมตัวกันซึ่งมีพลังงานอยู่
คุณสามารถรับข้อมูลต่อไปนี้:
- ยิ่งมีอนุภาคของรีเอเจนต์มากเท่าไร กลิ่นก็จะยิ่งอยู่ใกล้กันมากขึ้นเท่านั้น ก็ยิ่งมีโอกาสที่พวกมันจะมีปฏิกิริยาและตอบสนองมากขึ้นเท่านั้น
- ทำให้เกิดปฏิกิริยาเสียก่อน การเชื่อมต่อที่มีประสิทธิภาพถึง นี่คือวิธีที่ "ความสัมพันธ์เก่า" ต่อสู้และอ่อนแอลง และด้วยเหตุนี้ "ความสัมพันธ์ใหม่" จึงเกิดขึ้นได้ แต่ความรู้สึกผิดของแม่ส่วนนี้ยังมีพลังงานเพียงพอ
พลังงานส่วนเกินขั้นต่ำ (สูงกว่าพลังงานเฉลี่ยของอนุภาคในระบบ) ซึ่งจำเป็นสำหรับการหลอมรวมอนุภาคในระบบอย่างมีประสิทธิผล) เรียกว่าการหลอมรวมอนุภาครีเอเจนต์อย่างมีประสิทธิผลพลังงานกระตุ้น อีก.
คาดการณ์กิจกรรมของโรงเรียน
ฉันเข้าใจความหมายของบันทึกการนัดหมายที่โซชิต
ดังนั้นบนพื้นฐานของอนุภาคทั้งหมดที่ทำปฏิกิริยาจึงมีสิ่งกีดขวางพลังงานชนิดหนึ่งที่กระตุ้นพลังงานแบบดั้งเดิม เนื่องจากมีขนาดเล็ก จึงมีอนุภาคจำนวนมากที่สามารถเพิ่มเข้าไปได้สำเร็จ ด้วยอุปสรรคที่มีพลังอย่างมาก ร่างกายของคุณจึงต้องการพลังงานเพิ่มเติมเพื่อที่จะบรรลุ "โพสต์" ที่ดี ฉันจะจุดตะเกียงแอลกอฮอล์ - ฉันจะแจ้งพลังงานเพิ่มเติมให้คุณทราบ อีเอ,จำเป็นสำหรับการก่อตัวของสิ่งกีดขวางที่มีพลังสำหรับปฏิกิริยาของปฏิกิริยาระหว่างโมเลกุลแอลกอฮอล์กับโมเลกุลของกรด
มาดูกันดีกว่า โรงงาน, วิธีเพิ่มความลื่นไหลให้กับปฏิกิริยา
1) ธรรมชาติของคำพูดเชิงโต้ตอบ(สไลด์ 9) ภายใต้ธรรมชาติของสุนทรพจน์เชิงโต้ตอบ เราเข้าใจโครงสร้างของพวกเขา การไหลเข้าของอะตอมร่วมกันในสุนทรพจน์อนินทรีย์และอินทรีย์
ขนาดของพลังงานในการกระตุ้นการพูดเป็นพื้นฐานที่การไหลเข้าของธรรมชาติจะถูกระบุโดยปฏิกิริยาของคำพูดต่อความลื่นไหลของปฏิกิริยา
คำแนะนำ.
สูตร vysnovki อิสระ (เพิ่มเติม 3 บ้าน)
สภาพคล่องของปฏิกิริยาเคมีขึ้นอยู่กับหลายปัจจัย รวมถึงธรรมชาติของสารตั้งต้น ความเข้มข้นของสารตั้งต้น อุณหภูมิ และการมีอยู่ของตัวเร่งปฏิกิริยา ลองมาดูที่เจ้าหน้าที่เหล่านี้
1). ลักษณะของคำพูดเชิงโต้ตอบ-
2.) ทันทีที่มีปฏิสัมพันธ์ระหว่างไอออนกับพันธะไอออนิก ปฏิกิริยาจะเกิดขึ้นเร็วกว่าระหว่างซี่โครงกับพันธะโควาเลนต์- เพื่อให้เกิดปฏิกิริยาเคมี จำเป็นต้องรวมโมเลกุลของสารที่ทำปฏิกิริยาเข้าด้วยกัน จากนั้นโมเลกุลของสารจะเข้ามาใกล้กัน ดังนั้นอะตอมของส่วนหนึ่งจะได้รับผลกระทบจากสนามไฟฟ้าของอีกส่วนหนึ่ง เฉพาะในกรณีนี้เท่านั้นที่จะมีการเปลี่ยนแปลงของอิเล็กตรอนและการจัดเรียงอะตอมใหม่ซึ่งโมเลกุลของสารประกอบใหม่จะถูกสร้างขึ้น ดังนั้น ความเร็วของปฏิกิริยาเคมีจึงเป็นสัดส่วนกับจำนวนของสารประกอบที่มีอยู่ระหว่างโมเลกุล และจำนวนของสารประกอบก็เป็นสัดส่วนกับความเข้มข้นของสารประกอบที่ทำปฏิกิริยาในทางกลับกัน บนพื้นฐานของวัสดุทดลองนักวิทยาศาสตร์ชาวนอร์เวย์ Guldberg และ Waage และคำสอนของรัสเซียเกี่ยวกับ Becket ในปี 1867 ได้กำหนดกฎพื้นฐานของจลนพลศาสตร์เคมี -กฎของ chinnih mas
(ZDM): ที่อุณหภูมิคงที่ ความเร็วของปฏิกิริยาเคมีจะเป็นสัดส่วนโดยตรงกับความเข้มข้นของสารประกอบที่ทำปฏิกิริยาที่ระยะของสัมประสิทธิ์ปริมาณสัมพันธ์ สำหรับซากัล วิปัดกู:
กฎของมวลชีวิตมีลักษณะดังนี้: รายการกฎมวลแอคทีฟสำหรับปฏิกิริยานี้เรียกว่าปฏิกิริยาจลน์หลัก
-
โดยทั่วไป ค่าคงที่จลน์ k คือค่าคงที่การไหลของปฏิกิริยา ซึ่งขึ้นอยู่กับลักษณะของสารที่ทำปฏิกิริยาและอุณหภูมิ
ปฏิกิริยาเคมีส่วนใหญ่จะย้อนกลับ ในระหว่างปฏิกิริยาดังกล่าว ผลิตภัณฑ์จากการสะสมในโลกจะทำปฏิกิริยากับผลลัพธ์อย่างใดอย่างหนึ่งต่อไปนี้: สภาพคล่องของปฏิกิริยาโดยตรง::
ชวิดคิสโตสต์
ปฏิกิริยาการกลับตัว
ในช่วงเวลาแห่งการฟื้นฟู:
3) ไพโรฟอร์สามารถแขวนไว้บนแผ่นกระดาษกรองได้ ภายในหนึ่งชั่วโมง ส่วนที่พังของห้องโถงจะไหม้และทำให้กระดาษติดไฟกฎแห่งมวลชนที่กระตือรือร้นในค่ายแห่งความเท่าเทียมกันนั้นมองเห็นได้ชัดเจน:
de K - ค่าคงที่ของปฏิกิริยาที่เท่ากัน
-
ความลื่นไหลของปฏิกิริยาเคมีจะเพิ่มขึ้นเมื่ออุณหภูมิสูงขึ้น เรามาดูปฏิกิริยาระหว่างน้ำกับเปรี้ยวกันดีกว่า 2H 2 + O 2 = 2H 2 Oที่ 20 0 Z ความเร็วของปฏิกิริยาแทบจะเป็นศูนย์ และต้องใช้หิน 54 พันล้านก้อนในการทำปฏิกิริยาให้สมบูรณ์ 15% ที่อุณหภูมิ 500 0 C สารละลายน้ำต้องใช้ 50 ควิลิน และที่อุณหภูมิ 700 0 C ปฏิกิริยาจะเกิดขึ้น mittevo
4) ระดับความลื่นไหลของปฏิกิริยาขึ้นอยู่กับอุณหภูมิที่แสดงออกมาไม่ใช่กฎของฮอฟฟ์ : เมื่ออุณหภูมิเพิ่มขึ้น 10 ความลื่นไหลของปฏิกิริยาจะเพิ่มขึ้น 2 ถึง 4 เท่า กฎของ Van't Hoff เขียนไว้ว่า:การแช่ตัวเร่งปฏิกิริยา -สามารถควบคุมความเร็วของปฏิกิริยาเคมีได้ด้วยความช่วยเหลือ ตัวเร่งปฏิกิริยา(ความเร็วของปฏิกิริยาเปลี่ยนแปลง) การเร่งปฏิกิริยา บางครั้งตัวเร่งปฏิกิริยาถูกสร้างขึ้นในระหว่างการทำปฏิกิริยา กระบวนการดังกล่าวเรียกว่าตัวเร่งปฏิกิริยาอัตโนมัติ การเร่งปฏิกิริยาที่เป็นเนื้อเดียวกันและต่างกันมีความโดดเด่น
ที่ เป็นเนื้อเดียวกันตัวเร่งปฏิกิริยา ตัวเร่งปฏิกิริยา และสารที่ทำปฏิกิริยาอยู่ในเฟสเดียวกัน ตัวอย่างเช่น:
ที่ ต่างกันตัวเร่งปฏิกิริยา ตัวเร่งปฏิกิริยาและสปีชีส์ที่ทำปฏิกิริยานั้นมีอยู่ในระยะที่ต่างกัน ตัวอย่างเช่น:
การเร่งปฏิกิริยาแบบต่างกันของการจับโดยกระบวนการของเอนไซม์ หนวด กระบวนการทางเคมีเช่นเดียวกับสิ่งมีชีวิตที่ถูกเร่งปฏิกิริยาด้วยเอนไซม์ซึ่งเป็นโปรตีนที่มีหน้าที่เฉพาะทาง ในกระบวนการที่กระบวนการเอนไซม์เกิดขึ้น ไม่มีแกนกลางที่ต่างกันโดยทั่วไป และมีการเชื่อมต่อกับพื้นผิวของเฟสย่อยที่กำหนดไว้อย่างชัดเจน กระบวนการดังกล่าวนำไปสู่การเร่งปฏิกิริยาแบบจุลภาค
ปฏิกิริยาเคมีบางอย่างเกิดขึ้นจริงใน mittevo (การสั่นสะเทือนของส่วนผสมน้ำเปรี้ยว, ปฏิกิริยาการแลกเปลี่ยนไอออนในน้ำ), อื่น ๆ - ในน้ำร้อน, ปฏิกิริยาของสังกะสีกับกรด), tert i – สมบูรณ์ (การย้อมสีสนิม, การเน่าเปื่อยของสารอินทรีย์) . มีปฏิกิริยามากมายที่ผู้คนไม่สามารถสังเกตเห็นได้ ตัวอย่างเช่น การเปลี่ยนหินแกรนิตให้เป็นทรายและดินเหนียวต้องใช้เวลาหลายพันปี
กล่าวอีกนัยหนึ่ง ปฏิกิริยาเคมีสามารถเกิดขึ้นได้หลายวิธี ความสวีเดน.
เอลสโชดังนั้น ความลื่นไหลของปฏิกิริยา-
ความหมายที่แท้จริงของค่านี้ในทางคณิตศาสตร์คืออะไร?
ความลื่นไหลของปฏิกิริยาคือการเปลี่ยนแปลงปริมาณการพูดในหนึ่งหน่วยชั่วโมงและหนึ่งหน่วยหน้าที่ ในทางคณิตศาสตร์นิพจน์นี้เขียนเป็น: เดหมายเลข 1 และหมายเลข 2 – ปริมาณเสียงพูด (โมล) ณ เวลา t 1 และ t 2 สอดคล้องกับระบบระดับเสียง.
วี
เครื่องหมายที่เครื่องหมายบวกหรือลบ (±) อยู่ข้างหน้าการแสดงออกของสภาพคล่องนั้นอยู่ที่ความจริงที่ว่าการเปลี่ยนแปลงในปริมาณของคำใด ๆ ที่น่าประหลาดใจ - ผลิตภัณฑ์หรือตัวทำปฏิกิริยา
เห็นได้ชัดว่าในระหว่างการทำปฏิกิริยาจะมีการสูญเสียรีเอเจนต์ดังนั้นปริมาณจึงเปลี่ยนแปลงและสำหรับรีเอเจนต์ (n 2 - n 1) ค่าจะน้อยกว่าศูนย์เสมอ ส่วนของสภาพคล่องอาจเป็นค่าลบ ดังนั้นคุณต้องใส่เครื่องหมายลบหน้าค่า
หากเราสังเกตเห็นการเปลี่ยนแปลงมูลค่าของผลิตภัณฑ์ไม่ใช่รีเอเจนต์ก่อนการขยายตัวของของเหลวไม่จำเป็นต้องใช้เครื่องหมาย "ลบ" ส่วนที่เหลือของปฏิกิริยา (n 2 - n 1) จะเป็นค่าบวกเสมอเพราะ ความแข็งแรงของผลิตภัณฑ์อาจเพิ่มขึ้นอันเป็นผลจากปฏิกิริยา จำนวนคำพูด n โดยทั่วไปปริมาณการพูดจะมีเท่าใดเรียกว่าความเข้มข้นของฟันกราม:
ด้วยวิธีนี้ ตามแนวคิดเรื่องความเข้มข้นของฟันกรามและการแสดงออกทางคณิตศาสตร์ของเขา เราสามารถเขียนความเร็วปฏิกิริยาที่ระบุอีกเวอร์ชันหนึ่งได้:
ปฏิกิริยาของไหลคือการเปลี่ยนแปลงความเข้มข้นของโมเลกุลของโมเลกุลหลังจากปฏิกิริยาเคมีในหนึ่งชั่วโมง:
เจ้าหน้าที่ที่ใส่ความลื่นไหลของปฏิกิริยา
สิ่งสำคัญคือต้องรู้ว่าของเหลวอยู่ที่ไหนและปฏิกิริยาอื่นๆ มีปฏิกิริยาอย่างไร ตัวอย่างเช่น อุตสาหกรรมการกลั่นแนฟทาจ่ายค่าอาหารเสริมผิวให้กับผลิตภัณฑ์ต่อชั่วโมงอย่างแท้จริง แม้จะดูปริมาณแนฟทาจำนวนมากที่กำลังถูกทำให้บริสุทธิ์ แต่ก็ยังมีการไหลเข้าทางการเงินจำนวนมาก ในสถานการณ์เช่นนี้ สิ่งสำคัญคือต้องเสริมปฏิกิริยาให้แข็งแกร่งขึ้น โดยหยุดการกัดกร่อนของโลหะ
แล้วอะไรคือสาเหตุของความลื่นไหลของปฏิกิริยา? การนอนอยู่ที่นั่นราวกับว่ามันไม่น่าแปลกใจเมื่อคำนึงถึงความหลากหลาย พารามิเตอร์ต่างๆ.
เพื่อให้ทราบถึงสิ่งที่เกิดขึ้นจากปฏิกิริยาเคมี เช่น
สิ่งที่เขียนไว้ข้างต้นคือกระบวนการที่โมเลกุลของโมเลกุล A และ D รวมกันทีละโมเลกุล ทำให้เกิดโมเลกุลของโมเลกุล Z และ D
ดังนั้น แน่นอนว่าเพื่อให้ปฏิกิริยาเกิดขึ้น อย่างน้อยที่สุด จำเป็นต้องลดโมเลกุลของโมเลกุลเอาท์พุตลง แน่นอนว่าเมื่อเราเคลื่อนย้ายโมเลกุลจำนวนหนึ่งต่อปริมาตร จำนวนรถเมล์ก็จะเพิ่มขึ้นในลักษณะเดียวกับความถี่ของการชนกับผู้โดยสารบนรถบัสที่จองใหม่จะเพิ่มขึ้นตามความถี่ของการชนกับผู้โดยสาร
กล่าวอีกนัยหนึ่ง ความเร็วของปฏิกิริยาจะเพิ่มขึ้นตามความเข้มข้นของสารประกอบที่ทำปฏิกิริยาเพิ่มขึ้น
นอกจากนี้ หากหนึ่งในรีเอเจนต์หรือสารตั้งต้นมีก๊าซ ความเป็นของเหลวของปฏิกิริยาจะเพิ่มขึ้นเมื่อความดันถูกเคลื่อนย้าย และความดันต่อก๊าซจะเป็นสัดส่วนโดยตรงกับความเข้มข้นของโมเลกุลที่กักเก็บ
เวลาไม่น้อยจำเป็นต้องมีการรวมกันของอนุภาค แต่ไม่เพียงพอต่อปฏิกิริยาทางจิต ในทางกลับกัน เห็นได้ชัดว่าความหนาแน่นของโมเลกุลของสารที่ทำปฏิกิริยาที่ความเข้มข้นที่เหมาะสมนั้นมีมากจนปฏิกิริยาทั้งหมดดำเนินไปในขั้นตอนเดียว ในทางปฏิบัติสิ่งนี้เป็นไปไม่ได้ อะไรอยู่ทางขวา?
ทางด้านขวาคือไม่ใช่ว่าการรวมกันของโมเลกุลรีเอเจนต์ทุกครั้งจะมีประสิทธิภาพ มีการปิดและสปริงหลายครั้ง - โมเลกุลจะกระโดดไม่ทางใดก็ทางหนึ่งเหมือนลูกบอล เพื่อให้ปฏิกิริยาเกิดขึ้น โมเลกุลที่มีความผิดจะมีพลังงานจลน์เพียงพอ พลังงานขั้นต่ำที่โมเลกุลของสารทำปฏิกิริยาต้องการเพื่อให้ปฏิกิริยาเกิดขึ้นเรียกว่า พลังงานกระตุ้น และถูกกำหนดให้เป็น E a ในระบบที่ประกอบด้วยโมเลกุลจำนวนมาก โดยพื้นฐานแล้วจะมีการกระจายตัวของโมเลกุลตามพลังงาน บางชนิดมีพลังงานต่ำ บางชนิดมีพลังงานสูงและบางชนิดอยู่ตรงกลาง ในบรรดาโมเลกุลทั้งหมดนี้ พลังงานในส่วนเล็กๆ ของโมเลกุลมีมากกว่าพลังงานกระตุ้น
ดังที่คุณทราบจากหลักสูตรฟิสิกส์ อุณหภูมิเป็นตัววัดพลังงานจลน์ของอนุภาคที่ประกอบเป็นของเหลว นั่นเป็นเหตุผลว่าทำไมอนุภาคจึงสลายเร็วขึ้นเพื่อสร้างกระแส นั่นคืออุณหภูมิ ดังนั้น เห็นได้ชัดว่าการเพิ่มอุณหภูมิทำให้เราเพิ่มพลังงานจลน์ของโมเลกุลเป็นหลัก ซึ่งส่งผลให้จำนวนโมเลกุลที่มีพลังงานมากกว่า E เพิ่มขึ้น และการออกซิเดชันของพวกมันจะนำไปสู่ปฏิกิริยาทางเคมี
ข้อเท็จจริงของการไหลเข้าของอุณหภูมิเชิงบวกต่อสภาพคล่องของปฏิกิริยาได้รับการพิสูจน์เชิงประจักษ์ย้อนกลับไปในศตวรรษที่ 19 โดยนักเคมีชาวดัตช์ Van't Hoff ในขั้นตอนการสอบสวน เขาได้กำหนดกฎเกณฑ์การสวมชื่อและเสียงตามลำดับต่อไปนี้:
ความลื่นไหลของปฏิกิริยาเคมีใดๆ เพิ่มขึ้น 2-4 เท่า ทำให้อุณหภูมิเพิ่มขึ้น 10 องศา
การแทนค่าทางคณิตศาสตร์ของกฎนี้เขียนเป็น:
เดอ วี 2і วี 1- การไหลที่อุณหภูมิ t 2 และ t 1 สอดคล้องกัน และ γ คือค่าสัมประสิทธิ์อุณหภูมิของปฏิกิริยา ซึ่งค่าส่วนใหญ่มักจะอยู่ในช่วง 2 ถึง 4
บ่อยครั้งความลื่นไหลของปฏิกิริยาต่างๆ สามารถเคลื่อนย้ายได้ในลักษณะ Vikoristic ตัวเร่งปฏิกิริยา.
ตัวเร่งปฏิกิริยาเป็นสารที่เร่งปฏิกิริยาใดๆ และไม่สิ้นเปลือง
ตัวเร่งปฏิกิริยาใช้เพื่อเพิ่มความเร็วของปฏิกิริยาอย่างไร?
มาจำเกี่ยวกับพลังงานกระตุ้น E a กัน โมเลกุลที่มีพลังงานต่ำและพลังงานกระตุ้นต่ำกว่าไม่สามารถโต้ตอบทีละโมเลกุลได้หากไม่มีตัวเร่งปฏิกิริยา ตัวเร่งปฏิกิริยาที่เปลี่ยนเส้นทางที่ปฏิกิริยาเกิดขึ้นจะคล้ายกับการที่ผู้ควบคุมวงวางแผนเส้นทางการสำรวจไม่ใช่ผ่านภูเขาโดยตรง แต่โดยการเย็บวงเวียน แล้วจึงนำทางสหายเหล่านั้น ถ้าพวกมันไม่มีพลังงานเพียงพอที่จะ ขึ้นไปบนภูเขาพวกเขาสามารถย้ายไปที่จักรยาน α อื่นได้
แม้ว่าจะไม่มีการใช้ตัวเร่งปฏิกิริยาในระหว่างการทำปฏิกิริยา แต่โปรตีนก็มีส่วนร่วมโดยละลายปฏิกิริยาระดับกลางด้วยรีเอเจนต์แล้วกลับสู่สถานะดั้งเดิมจนกระทั่งสิ้นสุดปฏิกิริยา
นอกจากปัจจัยสำคัญที่มีอิทธิพลต่อความลื่นไหลของปฏิกิริยาระหว่างสารตั้งต้นและระหว่างส่วนต่างๆ (ปฏิกิริยาต่างกัน) ความลื่นไหลของปฏิกิริยายังขึ้นอยู่กับพื้นที่ของสารตั้งต้นด้วย ตัวอย่างเช่น คุณจะพบเม็ดอะลูมิเนียมโลหะที่ถูกโยนลงในหลอดทดลองที่มีสารละลายน้ำของกรดไฮโดรคลอริก อลูมิเนียมเป็นโลหะแอคทีฟที่ทำปฏิกิริยากับกรดที่ไม่ออกซิไดซ์ ด้วยกรดไฮโดรคลอริกปฏิกิริยาจะมีลักษณะดังนี้:
2Al + 6HCl → 2AlCl 3 + 3H 2
อลูมิเนียมเป็นสารที่เป็นของแข็ง ซึ่งหมายความว่าปฏิกิริยากับกรดไฮโดรคลอริกจะเกิดขึ้นบนพื้นผิวเท่านั้น เห็นได้ชัดว่าเนื่องจากเรามีพื้นที่ผิวที่ใหญ่กว่าซึ่งก่อนหน้านี้เคยให้เม็ดอะลูมิเนียมสัมผัสกับฟอยล์ เราจึงจำเป็นต้องมีอะตอมของอะลูมิเนียมจำนวนมากขึ้นเพื่อทำปฏิกิริยากับกรด ส่งผลให้ความลื่นไหลของปฏิกิริยาเพิ่มขึ้น ในทำนองเดียวกัน การเพิ่มขึ้นของพื้นผิวของวัสดุที่เป็นของแข็งสามารถได้รับจากผงของมัน
นอกจากนี้ การไหลของปฏิกิริยาที่ต่างกันซึ่งสารที่เป็นของแข็งทำปฏิกิริยากับสารที่คล้ายก๊าซหรือสารหายาก มักจะได้รับผลกระทบเชิงบวกจากการกวน ซึ่งเป็นผลมาจากการที่ระยะห่างจากโซนปฏิกิริยาเป็นผลจากการกวน ถึง o โมเลกุลของผลิตภัณฑ์ปฏิกิริยาที่สะสมและส่วนใหม่คือโมเลกุล "จ่าย" ให้กับรีเอเจนต์
ปริมาณที่เหลือยังมีส่วนสำคัญต่อความลื่นไหลของปฏิกิริยาและธรรมชาติของรีเอเจนต์อีกด้วย ตัวอย่างเช่น เนื่องจากไฮดรอกไซด์มีค่าต่ำกว่าในตารางธาตุ ฮาโลเจนส่วนใหญ่จึงทำปฏิกิริยากับน้ำ และฟลูออรีนในบรรดาฮาโลเจนทั้งหมดก็ทำปฏิกิริยากับน้ำคล้ายก๊าซ
เพื่อสรุปทั้งหมดที่กล่าวมา ความลื่นไหลของปฏิกิริยาอยู่ที่ ปัจจัยที่ก้าวหน้า:
1) ความเข้มข้นของรีเอเจนต์: ยิ่งความเข้มข้นสูง ความเร็วของปฏิกิริยาก็จะยิ่งมากขึ้น
2) อุณหภูมิ: เมื่ออุณหภูมิเพิ่มขึ้น ความลื่นไหลของปฏิกิริยาใดๆ จะเพิ่มขึ้น
3) พื้นที่สัมผัสของสารทำปฏิกิริยา: ยิ่งพื้นที่สัมผัสของรีเอเจนต์มากเท่าใด ความลื่นไหลของปฏิกิริยาก็จะยิ่งมากขึ้นเท่านั้น
4) การกวน หากปฏิกิริยาเกิดจากของเหลวหรือก๊าซที่เป็นของแข็ง การกวนสามารถเร่งให้เร็วขึ้นได้